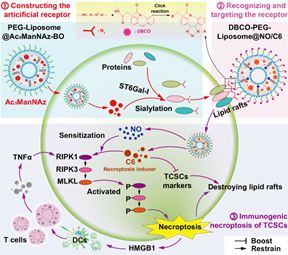
近日,我中心苏敏教授团队以“Nanointegrative Glycoengineering-Activated Necroptosis of Triple Negative Breast Cancer Stem Cells Enables Self-Amplifiable Immunotherapy for Systemic Tumor Rejection”为题目,在Adv Healthc Mater(2023 Dec 28:e2303337.)上发表研究论文,IF=10.0。赵友波副研究员为该文章的第一作者,苏敏、罗鹏教授为文章通讯作者,贵州医科大学为第一作者单位。三阴乳腺癌干细胞(TCSCs)被认为是乳腺癌复发的根源,该研究证实ST6β-半乳糖苷α-2,6-唾液酸转移酶1(ST6Gal-1)在TCSC中高度表达,TCSC可能对坏死敏感。用Ac3ManNAz(三乙酰化N-azidoacetyl-d-mannosamine)合成糖工程底物,用于诱导肿瘤细胞表达人工叠氮受体。应用二苯并环辛炔(DBCO)修饰的脂质体(DLip@NO/C6)通过人工叠氮受体向肿瘤细胞递送化合物C6(RIPK1/RIPK3/MLKL激活剂),以诱导坏死。促坏死作用被一氧化氮(NO)加重,最终引起肿瘤细胞坏死免疫原性增加,并释放损伤相关分子HMGB1,导致TCSCs在体内外被显著杀死。研究结果表明,通过糖工程设计和坏死诱导相结合的策略能够显著提升ST6Gal-1高表达TCSCs的治疗效果,是富有前景的肿瘤治疗策略。
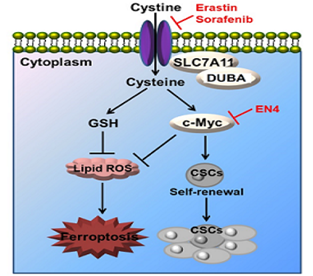
中心汪祖利副教授以第一作者身份、贵州医科大学为第一作者单位在Oncogene上(2023 Sep;42(36):2688-2700.) 发表题为“The DUBA-SLC7A11-c-Myc axis is critical for stemness and ferroptosis”的研究论文,IF=8.7。在该研究中,证明了未分化的肿瘤细胞比分化的肿瘤细胞对铁死亡更敏感,并且胱氨酸转运蛋白SLC7A11在分化的细胞中被去泛素酶DUBA高度上调。此外,DUBA通过去泛素化SLC7A11来促进肿瘤细胞干性。SLC7A11通过半胱氨酸显著增加c-Myc的表达,索拉非尼和c-Myc抑制剂EN4的组合对癌症治疗具有协同作用。DUBA-SLC7A11-c-Myc轴对于分化的癌症干细胞(CSCs)对抗铁死亡至关重要。文章揭示了肿瘤细胞干性和铁死亡之间的相互关系,并阐明了潜在的分子机制,为根除CSCs提供了一种具有前景的策略。
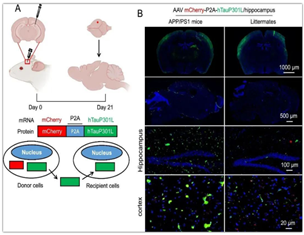
中心范安然副教授以共同第一作者的身份在Cellular andMolecular Life Sciences (CMLS)发表了题为“APP mediates uptake its tau and overexpression leads to the exacerbated taupathology”的研究论文,IF=9.2。淀粉样前体蛋白(APP)作为Aβ的前体和tau蛋白在阿尔茨海默病(AD)中发挥核心作用,但APP如何准确调控tau蛋白的细胞间传播,以及如何影响tau病理等问题,仍是目前研究中的空白和挑战。该研究证明了在AD中APP介导胞外tau蛋白的跨膜摄取,并在过表达时加剧tau蛋白病理。APP的N端与可溶性tau蛋白发生相互作用,并通过内吞作用携带tau蛋白进入细胞内部。使用APP-N端特异性拮抗剂6KApoEp短肽可以阻止tau蛋白的细胞内摄取。该研究从另一方面揭示了AD的病理机制,为开发新的AD治疗策略提供了潜在靶标。
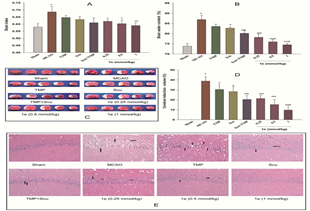
中心许键炜副教授以共同通信作者身份、贵州医科大学为第一作者单位在Bioorganic Chemistry 发表了题为Synthesis and bioevaluation of Scutellarein-Tertramethylpyrazine hybrid molecules for the treatment of ischemic stroke的研究论文,中科院分区1区,IF=5.1。 脑缺血中氧化应激后导致神经细胞损伤和功能障碍,目前没有理想的治疗药物。研究人员设计合成了两种灯盏乙素苷元-川芎嗪杂交分子,并研究发现所合成的杂交分子均表现出优异的神经保护作用和抗血小板活性。其中,具有良好Caco-2细胞透膜能力的化合物1e能够显著抑制Caco-2细胞对于Gly-Sar摄取。同时,在体肠灌注的结果也证实化合物1e的肠吸收显著增加。此外,化合物1e显著减少了MCAO/R大鼠的脑梗死体积。这一研究表明,分子杂交策略是改善单一靶向药物治疗效果的一种简单可行的方法,也为脑缺血的治疗提供了新思路。